Elementler ve Atomlar: Maddenin Yapı Taşları
Bir kum tanesinden bir yıldıza kadar- evrenin muhtevasına madde denir. Bilim insanları maddeyi yer kaplayan ve kütlesi olan her şey olarak tanımlamaktadır. Bir nesnenin kütlesi ve ağırlığı birbiriyle ilişkili kavramlardır, ancak tam olarak aynı değildir. Bir nesnenin kütlesi, nesnenin içerdiği madde miktarıdır ve nesnenin kütlesi, nesne ister Dünya'da ister uzayın yerçekimsiz ortamında olsun aynıdır. Öte yandan bir nesnenin ağırlığı, yerçekiminden etkilenen kütlesidir. Yerçekiminin bir nesnenin kütlesini güçlü bir şekilde çektiği yerlerde nesnenin ağırlığı, yerçekiminin daha az güçlü olduğu yerlerde olduğundan daha fazladır. Örneğin, belirli bir kütleye sahip bir nesne Ay'da Dünya'dakinden daha hafiftir, çünkü Ay'ın yerçekimi Dünya'nınkinden daha azdır. Başka bir deyişle, ağırlık değişkendir ve yerçekiminden etkilenir. Dünya'da bir kilo ağırlığında olan bir peynir parçası Ay'da sadece birkaç ons ağırlığındadır.
Elementler ve Bileşikler
Doğal dünyadaki tüm maddeler, element adı verilen 92 temel maddenin bir veya daha fazlasından oluşur. Bir element, sıradan kimyasal yollarla yaratılamaması veya parçalanamaması gerçeğiyle diğer tüm maddelerden ayrılan saf bir maddedir. Vücudunuz yaşam için gerekli kimyasal bileşiklerin birçoğunu kendilerini oluşturan elementlerden bir araya getirebilirken, element üretemez. Çevreden geliyor olmalılar. Almanız gereken bir elementin tanıdık bir örneği kalsiyumdur (Ca). Kalsiyum insan vücudu için gereklidir; emilir ve kemiklerin güçlendirilmesi de dahil olmak üzere bir dizi işlem için kullanılır. Süt ürünleri tükettiğinizde sindirim sisteminiz gıdayı kan dolaşımına geçebilecek kadar küçük bileşenlere ayırır. Bunlar arasında, bir element olduğu için daha fazla parçalanamayan kalsiyum da vardır. Bu nedenle peynirdeki temel kalsiyum, kemiklerinizi oluşturan kalsiyumla aynıdır. Aşina olabileceğiniz diğer bazı elementler oksijen, sodyum ve demirdir. İnsan vücudundaki elementler en bol bulunanlardan başlayarak aşağıdaki şekilde gösterilmiştir: oksijen (O), karbon (C), hidrojen (H) ve nitrojen (N). Her bir elementin adı bir veya iki harfli bir sembolle değiştirilebilir; bu ders dizisi sırasında bunlardan bazılarına aşina olacaksınız. Vücudunuzdaki tüm elementler yediğiniz gıdalardan ve soluduğunuz havadan elde edilir.
Doğada elementler nadiren tek başlarına bulunurlar. Bunun yerine, birleşerek bileşikler oluştururlar. Bileşik, kimyasal bağlarla bir araya gelmiş iki veya daha fazla elementten oluşan bir maddedir. Örneğin, glikoz bileşiği önemli bir vücut yakıtıdır. Her zaman aynı üç elementten oluşur: karbon, hidrojen ve oksijen. Dahası, herhangi bir bileşiği oluşturan elementler her zaman aynı nispi miktarlarda bulunur. Glikozda her on iki hidrojen birimine karşılık her zaman altı karbon ve altı oksijen birimi bulunur. Peki ama bu element "birimleri" tam olarak nedir?
Atomlar ve Atomaltı Parçacıklar
Atom, bir elementin kendine özgü özelliklerini koruyan en küçük miktarıdır. Başka bir deyişle, bir hidrojen atomu bir hidrojen birimidir - var olabilecek en küçük hidrojen miktarı. Tahmin edebileceğiniz gibi, atomlar neredeyse akıl almaz derecede küçüktür. Bu cümlenin sonundaki nokta milyonlarca atom genişliğindedir.
Atomun Yapısı ve Enerjisi
Atomlar, üç türü önemli olan daha da küçük atom altı parçacıklardan oluşur: proton, nötron ve elektron. Pozitif yüklü protonların ve yüksüz ("nötr") nötronların sayısı, atoma kütle kazandırır ve proton sayısı elementin kimliğini belirler. Çekirdeğin etrafında ışık hızına yakın bir hızla "dönen" negatif yüklü elektronların sayısı proton sayısına eşittir. Bir elektron, bir proton ya da nötronun yaklaşık 1/2000'de biri kütleye sahiptir.
Aşağıdaki şekilde bir atomun yapısını hayal etmenize yardımcı olabilecek iki model gösterilmektedir - bu durumda helyum (He). Gezegen modelinde, helyumun iki elektronu, halka olarak tasvir edilen sabit bir yörüngede çekirdeğin etrafında dönerken gösterilir. Bu model atomik yapıyı görselleştirmede yardımcı olsa da, gerçekte elektronlar sabit yörüngelerde hareket etmez, elektron bulutu adı verilen bir yapı içinde çekirdeğin etrafında düzensiz bir şekilde dolanırlar.
Bir atomun proton ve elektronları elektrik yükü taşır. Pozitif yüklü protonlar p+ olarak adlandırılır. Negatif yüke sahip olan elektronlar e- olarak adlandırılır. Bir atomun nötronlarının yükü yoktur: elektriksel olarak nötrdürler. Tıpkı bir mıknatısın çelik bir buzdolabına zıt yükleri birbirini çektiği için yapışması gibi, pozitif yüklü protonlar da negatif yüklü elektronları çeker. Bu karşılıklı çekim, atoma bir miktar yapısal kararlılık kazandırır. Pozitif yüklü çekirdeğin çekimi, elektronların uzağa gitmesini engellemeye yardımcı olur. Nötr bir atomdaki proton ve elektron sayısı eşittir, dolayısıyla atomun toplam yükü dengelidir.
Atom Numarası ve Kütle Numarası
Bir karbon atomu karbona özgüdür, ancak bir karbon protonu değildir. İster karbon, ister sodyum (Na) ya da demir (Fe) atomunda bulunsun, bir proton diğeriyle aynıdır. Aynı şey nötronlar ve elektronlar için de geçerlidir. Peki, bir elemente ayırt edici özelliklerini veren nedir - karbonu sodyum veya demirden bu kadar farklı kılan nedir? Cevap, her birinin içerdiği benzersiz proton miktarıdır. Karbon, atomlarında altı proton bulunan bir elementin tanımıyla karakterize edilen bir elementtir. Başka hiçbir elementin atomlarında tam olarak altı proton yoktur. Dahası, ister karaciğerinizde ister bir kömür parçasında bulunsun, tüm karbon atomları altı proton içerir. Böylece, atomun çekirdeğindeki proton sayısı olan atom numarası elementi tanımlar. Bir atom genellikle protonlarla aynı sayıda elektrona sahip olduğundan, atom numarası normal elektron sayısını da tanımlar.
En yaygın formlarında, birçok element protonlarla aynı sayıda nötron da içerir. Örneğin karbonun en yaygın formunun çekirdeğinde altı nötronun yanı sıra altı proton, yani toplam 12 atom altı parçacık bulunur. Bir elementin kütle numarası, çekirdeğindeki proton ve nötron sayılarının toplamıdır. Yani karbonun kütle numarasının en yaygın şekli 12'dir. (Elektronlar o kadar az kütleye sahiptir ki, atomun kütlesine kayda değer bir katkıda bulunmazlar). Karbon nispeten hafif bir elementtir. Uranyum (U) ise 238 kütle numarasına sahiptir ve ağır metal olarak adlandırılır. Atom numarası 92'dir (92 protonu vardır) ancak 146 nötron içerir; doğal olarak oluşan tüm elementler arasında en fazla kütleye sahiptir.
Aşağıdaki şekilde gösterilen elementlerin periyodik tablosu, doğada bulunan 92 elementin yanı sıra deneysel olarak keşfedilen daha büyük, kararsız birkaç elementi tanımlayan bir çizelgedir. Elementler atom numaralarına göre sıralanmıştır; hidrojen ve helyum tablonun en üstünde, daha büyük kütleli elementler ise en altta yer alır. Periyodik tablo yararlı bir araçtır çünkü her element için kimyasal sembolü, atom numarasını ve kütle numarasını tanımlar ve elementleri diğer elementlerle reaksiyona girme eğilimlerine göre düzenler. Bir elementteki proton ve elektron sayısı eşittir. Proton ve nötron sayısı bazı elementler için eşit olabilir, ancak hepsi için eşit değildir.
| İNTERAKTİF BAĞLANTI Periyodik tabloyu görmek için bu web sitesini ziyaret edin. Elementlerin periyodik tablosunda, tek bir sütundaki elementler kimyasal reaksiyona katılabilecek aynı sayıda elektrona sahiptir. Bu elektronlar " değerlik elektronları" olarak bilinir. Örneğin, ilk sütundaki elementlerin hepsinde tek bir değerlik elektronu, yani başka bir atomla kimyasal reaksiyonda " verilebilen" bir elektron vardır. Parantez içinde gösterilen kütle sayısının anlamı nedir? |
İzotoplar
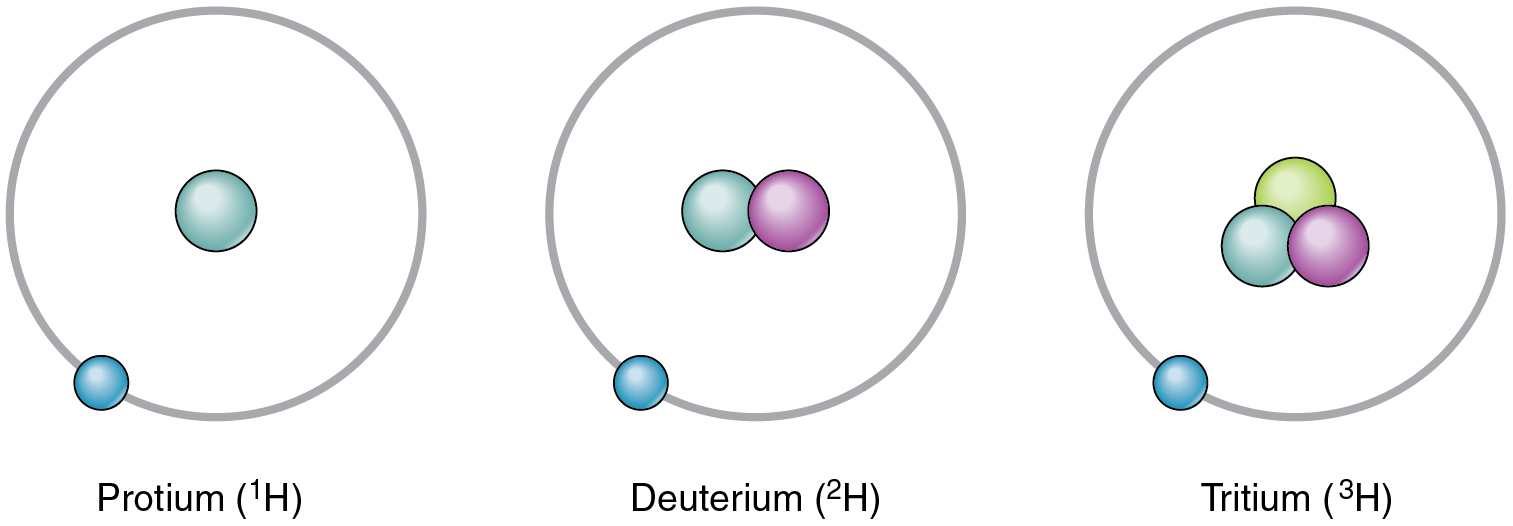
Her elementin kendine özgü bir proton sayısı olmasına rağmen, farklı izotoplar halinde bulunabilirler. Bir izotop, bir elementin farklı nötron sayılarıyla birbirinden ayrılan farklı formlarından biridir. Karbonun standart izotopu 12C'dir ve genellikle on iki karbon olarak adlandırılır. 12C'nin altı protonu ve altı nötronu vardır, dolayısıyla kütle numarası on ikidir. Karbonun tüm izotopları aynı sayıda protona sahiptir; bu nedenle 13C'nin yedi nötronu ve 14C'nin sekiz nötronu vardır. Bir elementin farklı izotopları, kütle numarası tire ile belirtilerek de gösterilebilir (örneğin, 12C yerine C-12). Hidrojenin aşağıdaki şeklide gösterilen üç yaygın izotopu vardır.
Normal nötron sayısından daha fazla nötron içeren bir izotop ağır izotop olarak adlandırılır. 14C buna bir örnektir. Ağır izotoplar kararsız olma eğilimindedir ve kararsız izotoplar radyoaktiftir. Radyoaktif bir izotop, çekirdeği kolayca bozunarak atom altı parçacıklar ve elektromanyetik enerji yayan bir izotoptur. Farklı radyoaktif izotoplar (radyoizotoplar olarak da adlandırılır), bir izotopun herhangi bir boyuttaki örneğinin yarısının bozunması için geçen süre olan yarı ömürleri bakımından farklılık gösterir. Örneğin, hidrojenin bir radyoizotopu olan trityumun yarı ömrü yaklaşık 12 yıldır; bu da bir numunedeki trityum çekirdeklerinin yarısının bozunmasının 12 yıl sürdüğünü gösterir. Radyoaktif izotoplara aşırı maruz kalmak insan hücrelerine zarar verebilir ve hatta kanser ve doğum kusurlarına neden olabilir, ancak maruz kalma kontrol edildiğinde, bazı radyoaktif izotoplar tıpta yararlı olabilir. Daha fazla bilgi için Kariyer Bağlantıları'na bakın.
| KARİYER BAĞLANTISI Girişimsel Radyolog Radyoizotopların kontrollü kullanımı, tıbbi teşhisi ve hastalık tedavisini geliştirmiştir. Girişimsel radyologlar, radyasyon içeren minimal invaziv teknikler kullanarak hastalıkları tedavi eden hekimlerdir. Bir zamanlar yalnızca uzun ve travmatik bir ameliyatla tedavi edilebilen pek çok durum artık ameliyatsız olarak tedavi edilebilmekte ve hastalar için maliyet, ağrı, hastanede kalış süresi ve iyileşme süresi azalmaktadır. Örneğin, geçmişte karaciğerinde bir veya daha fazla tümörü olan bir hasta için tek seçenek ameliyat ve kemoterapiydi (kanseri tedavi etmek için ilaç verilmesi). Ancak bazı karaciğer tümörlerine cerrahi olarak erişmek zordur ve diğerleri cerrahın karaciğerin çok büyük bir kısmını almasını gerektirebilir. Dahası, kemoterapi karaciğer için oldukça toksiktir ve bazı tümörler buna zaten iyi yanıt vermez. Bu tür bazı vakalarda, girişimsel bir radyolog, tümörleri, büyümeye devam etmeleri için ihtiyaç duydukları kan akışını bozarak tedavi edebilir. Radyoembolizasyon adı verilen bu prosedürde radyolog, hastanın kan damarlarından birinden geçirilen ince bir iğne ile karaciğere erişir. Radyolog daha sonra tümörleri besleyen kan damarlarına küçük radyoaktif "tohumlar" yerleştirir. İşlemi takip eden günler ve haftalarda, tohumlardan yayılan radyasyon damarları tahrip eder ve tedavi çevresindeki tümör hücrelerini doğrudan öldürür. Radyoizotoplar, görüntüleme teknolojileri tarafından tespit edilebilen ve izlenebilen atom altı parçacıklar yayar. Radyoizotopların tıptaki en gelişmiş kullanımlarından biri, hücrelerin enerji için kullandığı basit şeker olan radyoaktif glikozun çok küçük bir enjeksiyonunun vücuttaki aktivitesini tespit eden pozitron emisyon tomografisi (PET) tarayıcısıdır. PET kamera, tıbbi ekibe hastanın hangi dokularının en fazla glikozu aldığını gösterir. Böylece, metabolik olarak en aktif dokular görüntülerde parlak "sıcak noktalar" olarak görünür (aşağıdaki şekil). PET bazı kanserli kitleleri ortaya çıkarabilir çünkü kanser hücreleri hızlı üremelerini beslemek için yüksek oranda glikoz tüketirler. |
Elektronların Davranışları
İnsan vücudunda atomlar bağımsız varlıklar olarak mevcut değildir. Aksine, daha karmaşık maddeleri oluşturmak ve parçalamak için sürekli olarak diğer atomlarla reaksiyona girerler. Anatomi ve fizyolojiyi tam olarak anlamak için atomların bu tür reaksiyonlara nasıl katıldığını kavramanız gerekir. Anahtar, elektronların davranışını anlamaktır.
Elektronlar atomun çekirdeğinden belirli bir uzaklıkta rijit yörüngeleri takip etmeseler de, elektron kabukları adı verilen belirli uzay bölgelerinde kalma eğilimindedirler. Bir elektron kabuğu, çekirdeği farklı bir enerji seviyesinde çevreleyen bir elektron tabakasıdır.
İnsan vücudunda bulunan elementlerin atomları bir ila beş elektron kabuğuna sahiptir ve sadece iki elektron alabilen ilk kabuk hariç tüm elektron kabukları sekiz elektron alır. Elektron kabuklarının bu konfigürasyonu tüm atomlar için aynıdır. Kabukların kesin sayısı atomdaki elektron sayısına bağlıdır. Hidrojen ve helyumun sırasıyla sadece bir ve iki elektronu vardır. Elementlerin periyodik tablosuna bakarsanız, hidrojen ve helyumun en üst sıranın her iki yanında tek başlarına yer aldığını fark edeceksiniz; bunlar sadece bir elektron kabuğuna sahip tek elementlerdir (aşağıdaki şekil). Hidrojen ve helyumdan daha büyük tüm elementlerde elektronları tutmak için ikinci bir kabuk gereklidir.
Atom numarası 3 olan lityumun (Li) üç elektronu vardır. Bunlardan ikisi ilk elektron kabuğunu doldurur ve üçüncüsü ikinci bir kabuğa taşar. İkinci elektron kabuğu sekiz elektrona kadar barındırabilir. Karbon, altı elektronuyla birinci kabuğunu tamamen, ikinci kabuğunu ise yarı yarıya doldurur. Neon (Ne) on elektronla iki elektron kabuğunu tamamen doldurur. Yine periyodik tabloya baktığımızda, lityumdan neona kadar ikinci sıradaki tüm elementlerin sadece iki elektron kabuğuna sahip olduğunu görürüz. Ondan fazla elektrona sahip atomlar ikiden fazla kabuk gerektirir. Bu elementler periyodik tablonun üçüncü ve sonraki sıralarında yer alır.
Bir atomun kimyasal reaksiyonlara katılma eğilimini en güçlü şekilde yöneten faktör; değerlik kabuğundaki elektron sayısıdır. Değerlik kabuğu bir atomun en dış elektron kabuğudur. Değerlik kabuğu doluysa, atom kararlıdır; yani elektronlarının diğer atomların elektrik yükü tarafından çekirdekten çekilmesi olası değildir. Değerlik kabuğu dolu değilse, atom reaktiftir; yani değerlik kabuğunu dolu hale getirecek şekilde diğer atomlarla reaksiyona girme eğiliminde olacaktır. Bir elektronu değerlik kabuğunun sadece yarısını dolduran hidrojeni düşünün. Bu tek elektronun diğer elementlerin atomlarıyla ilişkiye girmesi muhtemeldir, böylece hidrojenin tek değerlik kabuğu stabilize edilebilir.
Tüm atomlar (tek elektron kabuklarına sahip hidrojen ve helyum hariç), değerlik kabuklarında tam olarak sekiz elektron olduğunda en kararlıdır. Bu ilke oktet kuralı olarak adlandırılır ve bir atomun kendi değerlik kabuğunda sekiz elektron olacak şekilde elektron vereceğini, kazanacağını veya başka bir atomla paylaşacağını belirtir. Örneğin, değerlik kabuğunda altı elektron bulunan oksijen, diğer atomlarla, oksijenin değerlik kabuğuna iki elektron eklenmesine ve sayının sekize çıkmasına neden olacak şekilde reaksiyona girebilir. İki hidrojen atomunun her biri tek elektronunu oksijenle paylaştığında, kovalent bağlar oluşur ve sonuçta bir su molekülü, H2O ortaya çıkar.
Doğada, bir elementin atomları diğer elementlerin atomlarıyla karakteristik şekillerde birleşme eğilimindedir. Örneğin, karbon genellikle değerlik kabuğunu dört hidrojen atomu ile bağlanarak doldurur. Bunu yaparken, iki element organik moleküllerin en basiti olan ve aynı zamanda Dünya'daki en bol ve kararlı karbon içeren bileşiklerden biri olan metanı oluşturur. Yukarıda belirtildiği gibi, bir başka örnek de sudur; oksijen değerlik kabuğunu doldurmak için iki elektrona ihtiyaç duyar. Genellikle iki hidrojen atomu ile etkileşime girerek H2O oluşturur. Bu arada, "hidrojen" adı onun suya katkısını yansıtır (hydro- = "su"; -gen = "yapıcı"). Dolayısıyla hidrojen "su yapıcı"dır.
Önceki Ders: Organizasyonun Kimyasal Seviyesi (Başlangıç)





Yorumlar
Yorum Gönder