İnsan İşlevleri için Gerekli İnorganik Bileşikler
Bu bölümde şimdiye kadar öğrendiğiniz kavramlar maddenin tüm formlarını yönetir ve biyolojinin yanı sıra jeoloji için de bir temel oluşturur. Bölümün bu kısmı odağı insan yaşamının kimyasına, yani vücudun yapısı ve işlevi için önemli olan bileşiklere daraltmaktadır. Genel olarak, bu bileşikler ya inorganik ya da organiktir.
- İnorganik bir bileşik, hem karbon hem de hidrojen içermeyen bir maddedir. Su (H2O) ve mideniz tarafından üretilen hidroklorik asit (HCl) gibi pek çok inorganik bileşik hidrojen atomu içerir. Buna karşılık, sadece birkaç inorganik bileşik karbon atomu içerir. Karbondioksit (CO2) bu az sayıdaki örnekten biridir.
- O halde organik bir bileşik, hem karbon hem de hidrojen içeren bir maddedir. Organik bileşikler, insan vücudu da dahil olmak üzere canlı organizmalarda kovalent bağlar yoluyla sentezlenir. Karbon ve hidrojenin vücudunuzda en çok bulunan ikinci ve üçüncü elementler olduğunu hatırlayın. Bu iki unsurun yediğiniz gıdalarda, vücut yapınızı oluşturan bileşiklerde ve işleyişinizi besleyen kimyasallarda nasıl bir araya geldiğini yakında keşfedeceksiniz.
Aşağıdaki bölümde yaşam için gerekli olan üç grup inorganik bileşik incelenmektedir: su, tuzlar, asitler ve bazlar. Organik bileşikler bölümün ilerleyen kısımlarında ele alınmaktadır.
Su
Bir yetişkinin vücut ağırlığının yüzde 70'i sudur. Bu su hem hücrelerin içinde hem de doku ve organları oluşturan hücrelerin arasında bulunur. Çeşitli rolleri, suyu insan işleyişi için vazgeçilmez kılmaktadır.
Kayganlaştırıcı ve Tampon Olarak Su
Su, vücudun kayganlık sağlayan sıvılarının çoğunun önemli bir bileşenidir. Tıpkı yağın bir kapının menteşesini yağlaması gibi, sinovyal sıvıdaki su da vücut eklemlerinin hareketlerini yağlar ve plevral sıvıdaki su akciğerlerin nefes alırken genişlemesine ve geri çekilmesine yardımcı olur. Sulu sıvılar, yiyeceklerin sindirim sistemi boyunca akmasına yardımcı olur ve komşu karın organlarının hareketinin sürtünmesiz olmasını sağlar.
Su aynı zamanda hücreleri ve organları fiziksel travmaya karşı korur, örneğin kafatası içindeki beyni tamponlar ve gözlerin hassas sinir dokusunu korur. Su, anne karnında gelişmekte olan bir fetüsü de yastıklar.
Isı Emici Olarak Su
Isı emici, ısıyı emen ve dağıtan ancak buna karşılık gelen bir sıcaklık artışı yaşamayan bir madde veya nesnedir. Vücutta su, kimyasal reaksiyonlar sonucu oluşan ısıyı, sıcaklıkta büyük bir artış olmadan emer. Dahası, çevre sıcaklığı yükseldiğinde, vücutta depolanan su vücudun serin kalmasına yardımcı olur. Bu soğutma etkisi, vücudun iç kısmından gelen sıcak kanın derinin hemen altındaki kan damarlarına akması ve çevreye aktarılmasıyla gerçekleşir. Aynı zamanda, ter bezleri terleme yoluyla sıcak su salarlar. Su buharlaşıp havaya karıştıkça ısıyı uzaklaştırır ve daha sonra çevreden gelen daha soğuk kan vücut merkezine geri döner.
Sıvı Karışımların Bir Bileşeni Olarak Su
Karışım, her biri kendi kimyasal kimliğini koruyan iki veya daha fazla maddenin birleşimidir. Başka bir deyişle, bileşen maddeler, kimyasal olarak yeni, daha büyük bir kimyasal bileşiğe bağlanmaz. Un ve şeker gibi toz halindeki maddeleri düşünürseniz, bu kavramı hayal etmek kolaydır; bunları bir kapta karıştırdığınızda, yeni bir bileşik oluşturmak için bağ oluşturmazlar. Soluduğunuz oda havası, üç ayrı element ( azot, oksijen ve argon) ve bir bileşik olan karbondioksit içeren gazlı bir karışımdır. Üç tür sıvı karışımı vardır ve bunların hepsi temel bileşen olarak su içerir. Bunlar çözeltiler, kolloidler ve süspansiyonlardır.
Vücuttaki hücrelerin hayatta kalabilmesi için solüsyon adı verilen su bazlı bir sıvı içinde nemli tutulmaları gerekir. Kimyada sıvı bir çözelti, çözünen madde olarak adlandırılan bir maddeden ve onu çözen bir çözücüden oluşur. Çözeltilerin önemli bir özelliği homojen olmalarıdır; yani çözünen moleküller çözelti boyunca eşit olarak dağılır. Bir çay kaşığı şekeri bir bardak suya karıştırırsanız, şeker, su molekülleri tarafından ayrılmış şeker molekülleri halinde çözünecektir. Bardağın sol tarafındaki şekerin suya oranı, bardağın sağ tarafındaki şekerin suya oranıyla aynı olacaktır. Daha fazla şeker eklerseniz, şekerin suya oranı değişir, ancak dağılım -iyi karıştırdığınız sürece- yine de eşit olur.
Su "evrensel çözücü" olarak kabul edilir ve bu nedenle yaşamın su olmadan var olamayacağına inanılır. Su kesinlikle vücutta en bol bulunan çözücüdür; esasen vücudun tüm kimyasal reaksiyonları suda çözünmüş bileşikler arasında gerçekleşir. Su molekülleri pozitif ve negatif elektrik yükü bölgelerine sahip polar yapıda olduğundan, su iyonik bileşikleri ve polar kovalent bileşikleri kolayca çözer. Bu tür bileşikler hidrofilik veya "suyu seven" olarak adlandırılır. Yukarıda da belirtildiği gibi, şeker suda iyi çözünür. Bunun nedeni, şeker moleküllerinin hidrojen-oksijen polar bağ bölgeleri içermesi ve bu sayede hidrofilik olmasıdır. Suda kolayca çözünmeyen polar olmayan moleküller hidrofobik veya "sudan korkan" olarak adlandırılır.
Çözünen Maddelerin Konsantrasyonları
Kimyada çeşitli çözünen madde ve su karışımları tanımlanmıştır. Belirli bir çözünen maddenin konsantrasyonu, o çözünen maddenin belirli bir alandaki parçacıklarının sayısıdır (oksijen atmosferik havanın yaklaşık yüzde 21'ini oluşturur). İnsanların kan dolaşımında glikoz konsantrasyonu genellikle desilitre (dL) başına miligram (mg) olarak ölçülür ve sağlıklı bir yetişkinde ortalama 100 mg/dL'dir. Bir çözünenin konsantrasyonunu ölçmenin bir başka yöntemi de molaritesidir; bu da litre (L) başına düşen molekül molüdür (M). Bir elementin molü onun atom ağırlığıdır, bir bileşiğin molü ise molekül ağırlığı olarak adlandırılan bileşenlerinin atom ağırlıklarının toplamıdır. Sıklıkla kullanılan bir örnek, kimyasal formülü C6H12O6 olan bir mol glikozun hesaplanmasıdır. Periyodik tabloyu kullanarak, karbonun (C) atom ağırlığı 12,011 gramdır (g) ve glikozda toplam 72,066 g atom ağırlığı için altı karbon vardır. Aynı hesaplamalar hidrojen (H) ve oksijen (O) için yapıldığında, molekül ağırlığı 180,156 g'a (glikozun "gram molekül ağırlığı") eşittir. Bir litre çözelti yapmak için su eklendiğinde, bir mol (1M) glikozunuz olur. Bu, mollerin "Avogadro sayısı" ile ilişkisi nedeniyle kimyada özellikle yararlıdır. Herhangi bir çözeltinin bir molünde aynı sayıda parçacık bulunur: 6.02 × 10^23. Kan dolaşımındaki ve vücudun diğer dokularındaki birçok madde molün binde biri veya milimol (mM) cinsinden ölçülür.
Bir kolloid, ağır bir çözelti gibi olan bir karışımdır. Çözelti tanecikleri, sıvı karışımını opak hale getirecek kadar büyük moleküllerin küçük kümelemelerinden oluşur (çünkü tanecikler ışığı saçmak için yeterince büyüktür). Kolloidlerin bilinen örnekleri süt ve kremadır. Tiroid bezlerinde tiroid hormonu, kolloid olarak da adlandırılan kalın bir protein karışımı olarak depolanır.
Süspansiyon, daha ağır bir maddenin bir sıvı içinde geçici olarak asılı kaldığı, ancak zamanla çöktüğü bir sıvı karışımıdır. Partiküllerin bir süspansiyondan bu şekilde ayrılmasına çökelme denir. Çökelmenin bir örneği, çökelme hızını veya çökelme oranını belirleyen kan testinde ortaya çıkar. Bu test, bir deney tüpünde bulunan kırmızı kan hücrelerinin (plazma olarak bilinen kanın su kısmından) belirli bir süre içinde ne kadar hızlı çöktüğünü ölçer. Sağlıklı bir vücutta kan hücrelerinin hızlı çökmesi normalde olmaz, ancak bazı hastalıkların belirli yönleri kan hücrelerinin bir araya yapışmasına neden olabilir ve bu ağır kan hücre kümelemeleri normal kan hücrelerinden daha hızlı bir şekilde deney tüpünün dibine çöker.
Kimyasal Tepkimelerde Suyun Önemi
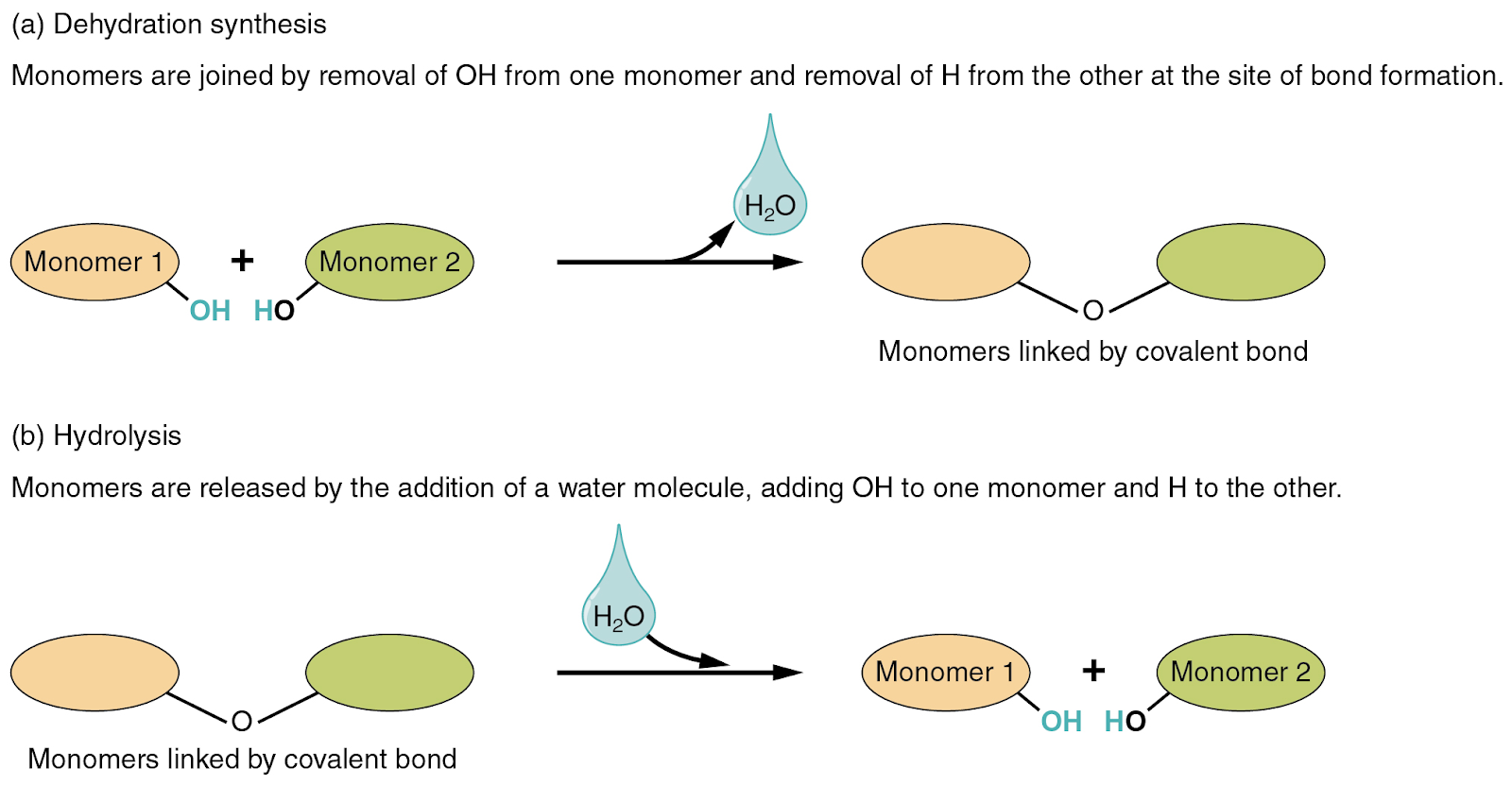
İki tür kimyasal tepkime su oluşumunu veya tüketimini içerir: dehidrasyon sentezi ve hidroliz.
- Dehidrasyon sentezinde, yeni bir ürünün sentezinde bir reaktan bir hidrojen atomu ve başka bir reaktan bir hidroksil grubu (OH) verir. Kovalent bağ oluşumunda, yan ürün olarak bir molekül su açığa çıkar (aşağıdaki şekil). Bu bazen yoğuşma tepkimesi olarak da adlandırılır.
- Hidrolizde, bir su molekülü bir bileşiği parçalayarak bağlarını koparır. Suyun kendisi de H ve OH'ye ayrılır. Kopan bileşiğin bir kısmı daha sonra hidrojen atomuyla, diğer kısmı ise hidroksil grubuyla bağlanır.
Bu tepkimeler tersinirdir ve organik bileşiklerin kimyasında önemli bir rol oynar (kısa bir süre sonra ele alınacaktır).
Tuzlar
İyonlar iyonik bağlar oluşturduğunda tuzların oluştuğunu hatırlayın. Bu tepkimelerde atomlardan biri bir veya daha fazla elektron vererek pozitif yüklü hale gelirken, diğeri bir veya daha fazla elektron alarak negatif yüklü hale gelir. Artık bir tuzu, suda çözündüğünde H+ veya OH- dışındaki iyonlara ayrışan bir madde olarak tanımlayabilirsiniz. Bu gerçek, tuzları asitlerden ve bazlardan ayırmak için önemlidir, daha sonra tartışılacaktır.
Tipik bir tuz olan NaCl suda tamamen ayrışır (aşağıdaki şekil). Su molekülünde pozitif ve negatif bölgeler (sırasıyla hidrojen ve oksijen uçları) negatif klorür ve pozitif sodyum iyonlarını çeker ve birbirlerinden uzaklaştırır. Tekrar belirtmek gerekirse, çözeltide polar ve apolar kovalent bağlı bileşikler moleküllere ayrılırken, tuzlar iyonlara çözünürler. Bu iyonlar elektrolittir; çözelti içinde elektrik akımı iletebilirler. Bu özellik, iyonların sinir uyarılarını iletme ve kas kasılmasını tetikleme işlevi için kritik öneme sahiptir.
Diğer birçok tuz vücutta önemlidir. Örneğin, karaciğer tarafından üretilen safra tuzları diyet yağlarının parçalanmasına yardımcı olur ve kalsiyum fosfat tuzları diş ve kemiklerin mineral kısmını oluşturur.
Asitler ve Bazlar
Asitler ve bazlar, tuzlar gibi, suda elektrolitlere ayrışır. Asitler ve bazlar, içinde çözündükleri çözeltilerin özelliklerini çok fazla değiştirebilir.
Asitler
Asit, çözeltide hidrojen iyonları (H+) açığa çıkaran bir maddedir (aşağıdaki şeklin yukarısındaki görselleri). Bir hidrojen atomu sadece bir proton ve bir elektrona sahip olduğundan, pozitif yüklü bir hidrojen iyonu, basitçe bir protondan ibarettir. Bu tek protonun kimyasal reaksiyonlara katılma olasılığı yüksektir. Kuvvetli asitler, çözeltideki tüm H+'larını serbest bırakan bileşiklerdir; yani tamamen iyonize olurlar. Mide zarındaki hücrelerden salınan hidroklorik asit (HCl) güçlü bir asittir çünkü tüm H+'larını midenin sulu ortamında serbest bırakır. Bu güçlü asit sindirime yardımcı olur ve yutulan mikropları öldürür. Zayıf asitler tamamen iyonlaşmaz; yani hidrojen iyonlarının bir kısmı çözeltideki bir bileşik içinde bağlı kalır. Zayıf bir asit örneği sirke veya asetik asittir; bir protonu bıraktıktan sonra asetat olarak adlandırılır.
Bazlar
Baz, çözeltide hidroksil iyonları (OH-) açığa çıkaran veya çözeltide zaten mevcut olan H+'yı kabul eden bir maddedir (yukarıdaki şeklin aşağıdaki görselleri). Hidroksil iyonları (hidroksit iyonları olarak da bilinir) veya diğer bazik maddeler mevcut H+ ile birleşerek bir su molekülü oluşturur, böylece H+ giderilir ve çözeltinin asitliği azalır. Güçlü bazlar hidroksil iyonlarının çoğunu veya tamamını serbest bırakır; zayıf bazlar sadece bazı hidroksil iyonlarını serbest bırakır veya sadece birkaç H+ absorbe eder. Mideden gelen hidroklorik asitle karışan yiyecekler, H+ çeken zayıf bir baz olan bikarbonat (HCO3-) salınımı olmasaydı, sindirim sisteminin mideden sonraki kısmı olan ince bağırsağı yakardı. Bikarbonat H+ protonlarının bir kısmını kabul eder ve böylece çözeltinin asitliğini azaltır.
pH Kavramı
Bir çözeltinin bağıl asitliği veya alkalinitesi pH değeri ile gösterilebilir. Bir çözeltinin pH değeri, çözeltinin hidrojen iyonu (H+) derişiminin negatif, 10 tabanlı logaritmasıdır. Örnek olarak, pH 4 çözeltisi pH 5 çözeltisinden on kat daha fazla H+ konsantrasyonuna sahiptir. Yani, pH değeri 4 olan bir çözelti, pH değeri 5 olan bir çözeltiden on kat daha asidiktir. Aşağıdaki şekilde gösterildiği gibi pH ölçeğini incelediğinizde pH kavramı daha anlamlı hale gelmeye başlayacaktır. Bu ölçek, 0 ile 14 arasında değişen bir dizi artıştan oluşur. pH değeri 7 olan bir çözelti nötr olarak kabul edilir; ne asidik ne de baziktir. Saf suyun pH değeri 7'dir. Sayı 7'den ne kadar düşükse, çözelti o kadar asidiktir veya H+ derişimi o kadar yüksektir. Her pH değerindeki hidrojen iyonu derişimi bir sonraki pH değerinden 10 kat farklıdır. Örneğin, 4 pH değeri 10^-4 M veya 0,0001M proton konsantrasyonuna karşılık gelirken, 5 pH değeri 10^-5 M veya 0,00001M proton konsantrasyonuna karşılık gelir. Sayı 7'nin üzerinde ne kadar yüksekse, çözelti o kadar bazik (alkali) veya H+ konsantrasyonu o kadar düşük demektir. Örneğin insan idrarı saf sudan on kat daha asidiktir ve HCl sudan 10.000.000 kat daha asidiktir.
Tamponlar
İnsan kanının pH değeri normalde 7,35 ila 7,45 arasında değişir, ancak tipik olarak pH 7,4 olarak tanımlanır. Bu hafif bazik pH değerinde kan, vücuttaki trilyonlarca hücre tarafından sürekli olarak kan dolaşımına salınan karbondioksitten (CO2) kaynaklanan asitliği azaltabilir. Homeostatik mekanizmalar (nefes alırken CO2 salınımı ile birlikte) normalde kanın pH değerini bu dar aralıkta tutar. Bu çok önemlidir, çünkü dalgalanmalar (çok asidik veya çok alkali) hayatı tehdit eden rahatsızlıklara yol açabilir.
Vücuttaki tüm hücreler, asit-baz dengesinin yaklaşık 7,4 pH değerinde homeostatik olarak düzenlenmesine bağlıdır. Bu nedenle vücudun bu düzenleme için nefes alma, kimyasalların idrarla atılması ve tampon olarak adlandırılan kimyasalların vücut sıvılarına salınmasını içeren çeşitli mekanizmaları vardır. Tampon, zayıf bir asit ve onun eşlenik bazından oluşan bir çözeltidir. Bir tampon, vücut sıvılarındaki az miktardaki asit veya bazları nötralize edebilir. Örneğin, bir vücut sıvısının pH'ında 7,35'in altına hafif bir düşüş bile olsa, sıvıdaki tampon -bu durumda zayıf bir baz olarak hareket eder- fazla hidrojen iyonlarını bağlayacaktır. Buna karşılık, pH 7,45'in üzerine çıkarsa, tampon zayıf bir asit gibi davranacak ve hidrojen iyonlarına katkıda bulunacaktır.
| HOMEOSTATİK DENGESİZLİKLER Asitler ve Bazlar Kan ve diğer vücut sıvılarının aşırı asitli olması asidoz olarak bilinir. Asidozun yaygın nedenleri, nefes almanın etkinliğini, özellikle de kişinin tam olarak nefes verme yeteneğini azaltan ve kan dolaşımında CO2 (ve H+) birikmesine neden olan durumlar ve bozukluklardır. Asidoz, baz görevi gören tamponların seviyesini veya işlevini azaltan veya asit üretimini teşvik eden metabolik sorunlardan da kaynaklanabilir. Örneğin, şiddetli ishal durumunda vücuttan çok fazla bikarbonat kaybedilebilir ve bu da vücut sıvılarında asitlerin birikmesine neden olur. Kötü yönetilen diyabeti olan kişilerde (kan şekerinin etkin bir şekilde düzenlenememesi), vücut yakıtı olarak keton adı verilen asitler üretilir. Bunlar kanda birikerek diyabetik ketoasidoz adı verilen ciddi bir duruma neden olabilir. Böbrek yetmezliği, karaciğer yetmezliği, kalp yetmezliği, kanser ve diğer bozukluklar da metabolik asidoza neden olabilir. Buna karşılık alkaloz, kanın ve diğer vücut sıvılarının çok alkalin (bazik) olduğu bir durumdur. Asidozda olduğu gibi, solunum bozuklukları önemli bir nedendir; ancak solunum alkalozunda karbondioksit seviyeleri çok düşer. Akciğer hastalığı, aşırı dozda aspirin, şok ve sıradan anksiyete, normal H+ konsantrasyonunu azaltan solunum alkalozuna neden olabilir. Metabolik alkaloz genellikle hidrojen ve klorür iyonlarının (HCl bileşenleri olarak) kaybına neden olan uzun süreli, şiddetli kusmadan kaynaklanır. İlaçlar da alkaloza neden olabilir. Bunlar, vücudun potasyum iyonlarını kaybettiren diüretikler ve örneğin kalıcı mide ekşimesi veya ülseri olan biri tarafından aşırı miktarda alındığında antasitler gibi ilaçları içerir. |



Yorumlar
Yorum Gönder